搶打輝瑞疫苗各安天命 美國4.3萬人測試6人死亡 英倫緊急應市兩人不適
由美國藥廠輝瑞及德國生物科技公司BioNTech合作研發的新冠肺炎疫苗,前日在英國大規模接種,但翌日就有至少兩人出現過敏反應。美國食品及藥物管理局(FDA)發表文件,首度證實有6人在臨床測試階段死亡,但未對其安全性及有效性提出新疑問。總統特朗普堅信,疫苗可迅速及明顯降低死亡及入院人數。
英警告有過敏史勿接種
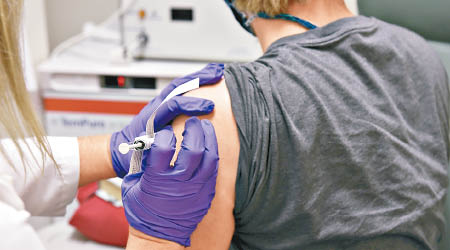
兩名英國國家衞生事務局(NHS)人員前日接種輝瑞疫苗後,均出現過敏反應。政府部門藥物及健康產品監管局(MHRA)警告,對藥物、食物或疫苗有嚴重過敏史的人士現階段不要去接種輝瑞疫苗。英國前日開始大規模接種疫苗計劃,90歲老婦凱南成為全球首名接種輝瑞疫苗的人士。
在傳出英國有人出現過敏反應前,美國FDA發表輝瑞疫苗分析數據,指有43,448人接受測試,年齡中位數為51歲;其中正式注射疫苗一組有21,720人,而使用安慰劑一組有21,728人。測試結果顯示,疫苗一組只有8宗確診病例,相反安慰劑一組有162宗,因此疫苗整體平均有效率達95%。至於55歲以上人士及只注射第一劑疫苗的測試者,其平均有效率亦分別達到93.8%和82%。
美國藥管局今起審批
報告亦首度提及,在疫苗後期試驗階段有測試者死亡,其中二人來自疫苗一組,另外4人則是安慰劑一組,死亡率為0.01%,FDA認為比率與一般情況相近。兩名接種輝瑞疫苗死亡人士年齡均超過55歲,其中一人在接種疫苗後62天因心臟驟停死亡,而另一人則於接種3日後,死於動脈硬化。FDA透露,轄下諮詢組織疫苗和相關生物產品諮詢委員會(VRBPAC)今日舉行會議,並聽取專家有否充分科學理據,支持緊急應用疫苗。
來自加州大學洛杉磯分校護士學院助理教授克麗絲滕‧蔡(Kristen Choi,音譯)亦稱,她8月曾接受輝瑞疫苗測試,不知自己屬於安慰劑抑或疫苗一組,當接種第一劑疫苗時只覺得疼痛,但在第二劑後出現頭暈、發冷、惡心及發燒等副作用,一度質疑自己確診新冠肺炎。
牛津疫苗有效率達標
FDA公布文件後,總統特朗普在白宮舉行的疫苗峰會上表示,他希望FDA數日內向輝瑞疫苗批出緊急使用授權,並指樂見另一藥廠莫德納(Moderna)研發的疫苗獲批。他表明,若藥廠在生產足夠疫苗遇上困難,或會引用《國防生產法》促成其事。
除輝瑞外,英國藥廠阿斯利康與牛津大學研發的新冠肺炎腺病毒ChAdOx1載體疫苗,亦於前日發表新數據,宣稱其平均有效率達70.49%,高於美國FDA訂下的50%最低標準。阿斯利康疫苗有效率比輝瑞或莫德納疫苗為低,但較為便宜,亦容易儲存及運送。本報綜合報道